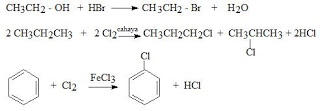
Reaksi Substitusi
Jenis - jenis reaksi
Jumlah dan cakupan reaksi organik sangat besar dan
tampak membingungkan, tapi sebenarnya hampir semuanya dapat digolongkan ke
dalam enam kategori. Di dalam contoh reaksi berikut, produk yang dapat segera
terbentuk ikut diperlihatkan namun semua spesies diperlihatkan tanpa muatan.
Hal ini dilakukan berdasarkan pemikiran bahwa reaktan-reaktan yang muatannya
berbeda dapat mengalami perubahan yang analog.
1. Substitusi.
Jika heterolitik, maka reaksi dapat digolongkan sebagai nukleofil atau
elektrofil, tergantung pada reaktan mana yang ditandai sebagai substrat dan
yang mana sebagai pereaksi penyerang.
a. Substitusi nukleofilik.
b. Substitusi elektrofilik.
c. Substitusi radikal bebas.
Di dalam substitusi radikal bebas, Y·
biasanya dihasilkan secara insitu melalui pemecahan radikal bebas, dan X· akan
bereaksi lebih lanjut.
2. Adisi
ke dalam ikatan rangkap dua atau rangkap tiga. Reaksi ini dapat terjadi
melalui semua dari tiga mekanisme yang mungkin.
a. Adisi
elektrofilik (heterolitik).
b. Adisi nukleofilik
c. Adisi radikal bebas (homolitik)
d. Adisi
secara serempak (perisiklik).
Contoh di atas memperlihatkan Y dan W
datang dari molekul yang sama, tapi sangat sering (kecuali dalam adisi secara
serempak) Y dan W datang dari molekul yang berbeda. Pada contoh di atas
memperlihatkan pula pemutusan ikatan Y-W terjadi pada waktu yang sama dengan Y
terikat ke B, tapi sering (kecuali dalam adisi secara serempak) pemutusan
ikatan tersebut terjadi lebih awal.
3.
β-eliminasi
Reaksi ini dapat terjadi melalui
mekanisme heterosiklik dan perisiklik. β-eliminasi
radikal bebas sangat jarang. Di dalam eliminasi siklik, W atau X memungkinkan
pergi secara bersamaan atau mungkin juga tidak, dan memungkinkan pula untuk
bergabung atau juga tidak.
4.
Penataan ulang. Banyak penataan ulang melibatkan perpindahan atom
atau gugus dari satu atom ke atom yang lain. Ada tiga jenis, tergantung pada
berapa banyak elektron yang di bawa oleh atom atau gugus yang berpindah.
a. Perpindahan
dengan pasangan elektron (nukleofil).
b. Perpindahan dengan satu elektron (radikal bebas)
c. Perpindahan
tanpa elektron (elektrofilik; jarang)
Penataan ulang yang diperlihatkan di
atas hanya melibatkan penataan ulang-1,2 dalam nama gugus berpindah ke atom di
dekatnya. Hal tersebut adalah yang paling umum, meskipun dimungkinkan pula
penataan ulang jarak jauh. Ada pula sejumlah penataan ulang yang tidak
melibatkan perpindahan yang sederhana, beberapa diantaranya melibatkan
mekanisme perisiklik.
5.
Oksidasi dan reduksi. Banyak reaksi oksidasi dan reduksi yang tidak
dapat dimasukkan ke dalam empat jenis penggolongan di atas.
6.
Kombinasi dari penggolongan
di atas.
Perlu dicatat bahwa anak panah digunakan untuk memperlihatkan
perpindahan elektron. Satu anak panah selalu diikuti dengan gerakan elektron
dan bukan inti atau sesuatu yang lain. Anak panah asli (berkepala rangkap) diikuti
dengan pasangan elektron, dan anak panah berkepala tunggal (kepala kail)
diikuti dengan elektron tak berpasangan.
Reaksi
Substitusi
Reaksi substitusi adalah suatu reaksi
penggantian gugus fungsional pada senyawa kimia tertentu dengan gugus
fungsional yang lain. Dalam kimia organik, reaksi substitusi elektrofilik dan
nukleofilik merupakan yang paling penting dan banyak digunakan. Reaksi
substitusi organik dikategorikan menjadi beberapa tipe berdasarkan reagen yang
berperan, apakah termasuk nukleofil atau elektrofil. Intermediet yang terlibat
dalam reaksi substitusi dapat berupa karbokation, karbanion, atau radikal
bebas. Reaksi substitusi terjadi apabila sebuah atom atau gugus yang
berasal dari pereaksi menggantikan sebuah atom atau gugus dari molekul yang
bereaksi. Reaksi substitusi dapat terjadi pada atom karbon jenuh atau tak jenuh.
Mekanisme SN2 dan
SN1
Di dalam substitusi nukleofilik,
pereaksi penyerang (nukleofil) membawa sepasang elektron kepada substrak,
menggunakan pasangan elektron tersebut untuk membentuk ikatan baru, dan
gugus-pergi (nucleofuge) pergi
menjauh dengan membawa satu pasangan elektron.
Persamaan ini tanpa pemperlihatkan muatan. Y dapat saja
netral atau bermuatan negatif dan RX juga dapat netral atau bermuatan positif.
Dalam semua hal, Y harus mempunyai pasangan elektron bebas (elektron bukan
ikatan), jadi semua nukleofil adalah basa Lewis. Jika Y adalah pelarut maka
reaksi disebut solvolisis. Substitusi
nukleofil pada suatu karbon alkil disebut alkilasi nukleofilik. Sebagai contoh
adalah pada reaksi tipe II di atas di mana RI mengalkilasi NMe3,
maka reaksinya disebut alkilasi trimetilamina. Hal yang serupa, substitusi pada
karbon asil adalah asilasi nukleofilik.
Ada beberapa mekanisme berbeda yang
mungkin untuk reaksi substitusi nukleofilik alifatik, tergantung pada substrat,
nukleofil, gugus-pergi, dan kondidsi reaksi. Di dalam semua mekanisme tersebut,
pereaksi penyerang membawa pasangan elektron kepada substrat sehingga kemiripan
mekanisme-mekanisme tersebut lebih besar daripada perbedaannya.
Mekanisme SN2
SN2 adalah simbol yang diberikan untuk
substitusi nuklefilik bimolekul. Di dalam mekanisme ini terdapat serangan pada
sisi belakang, nukleofil mendekati substrat dari posisi 180° menjauh dari
gugus-pergi. Reaksi tersebut adalah proses satulangkah tanpa spesies-antara,
ikatan C-Y terbentuk bersamaan dengan putusnya ikatan C-X.
Energi yang diperlukan untuk memutuskan ikatan C-X disuplai
oleh energi pembentukan ikatan C-Y yang terjadi secara bersamaan dengannya.
Posisi atomatom pada puncak energi aktivasi dapat dinyatakan seperti struktur . Tentu saja reaksi tidak berhenti di
sini (keadaan transisi). Gugus X harus pergi bersamaan dengan datangnya Y sebab
kulit valensi atom karbon tidak mampu menanpung lebih dari delapan elektron.
Pada saat keadaan transisi tercapai, atom karbon pusat segera berubah dari
hibrida sp3 menjadi hibrida sp2 dengan orbital p yang tegak lurus pada bidang datar.
Satu cuping (lobe) orbital p overlap dengan orbital nukelofil dan
cuping yang lain overlap dengan orbital gugus-pergi. Inilah sebabnya sehingga
di dalam mekanisme SN2
tidak pernah ditemukan serangan nukleofil dari sisi depan (sisi di mana
gugus-pergi akan pergi). Di dalam struktur hipotetik keadaan transisi serangan
dari sisi depan, kedua nukleofil dan gugus-pergi overlap dengan cuping orbital p yang sama. Sementara di dalam
peristiwa tersebut, nukleofil akan memaksimalkan overlap (alias pengisian
orbital) dan gugus-pergi akan melakukan pengahapusan overlap (alias pengosongan
orbital). Dengan kata lain, terjadi pengisian dan pengosongan pada orbital sama
dan waktu yang sama pula. Hal ini seperti ini tidak mungkin terjadi. Selama
keadaan transisi, ketiga gugus yang tidak bereaksi akan sebidang dengan atom
karbon pusat. Keempatnya benar-benar akan sebidang jika gugus yang masuk sama
dengan gugus yang keluar.
Bukti jenis lain untuk mekanisme SN2 datang dari senyawa yang
potensi gugus-pergi ada pada karbon ujung jembatan. Jika mekanisme SN2 adalah benar, maka
senyawa-senyawa seperti itu tidak akan mampu bereaksi melalui mekanisme ini
karena nukleofil tidak mampu mendekati dari arah belakang. Di antara
bukti-bukti yang telah diketahui, dua contoh kegagalan reaksi SN2 pada karbon jembatan
adalah pengolahan sistem [2,2,2] (senyawa 2)
dengan ion etoksida, dan pengolahan sistem [3,3,1] (senyawa 3) dengan natrium iodida dalam aseton.
Kedua senyawa tersebut justru mengarah pada reaksi pembukaan cincin.
Mekanisme SN1
Versi mekanisme SN1
(substitusi nukleofilik unimolekul) yang paling ideal adalah terdiri atas dua
tahap seperti berikut.
Perlu diingatkan kembali bahwa nukleofil di sini dapat
bermuatan atau tidak sehingga muatan padanya tidak dituliskan. Tahap pertama
reaksi SN1 adalah langkah
lambat ionisasi substrat, dan langkah ini sebagai langkah penentu kecepatan
reaksi. Langkah kedua adalah reaksi cepat antara zat-antara dengan nukleofil.
Proses ionisasi selalu dibantu oleh
pelarut karena kebutuhan energi untuk memutuskan ikatan sebagian besar dipenuhi
oleh solvasi R+ dan X. sebagai contoh, ionisasi t-BuCl menjadi t-Bu+
dan Cl- di dalam fase gas tanpa pelarut memerlukan 150
kkal/mol. Di dalam sistem tanpa pelarut, proses sederhana ini tidak akan
terjadi, kecuali suhu ditinggikan. Di dalam air, ionisasi ini hanya memrlukan
20 kkal/mol. Selisihnya adalah energi pelarut. Di dalam hal ini, pelarut
mempunyai peranan membantu perginya gugus-pergi dari sisi depan.
Pasangan ion dalam
mekanisme SN1
Sama dengan fakta kinetik, fakta stereokimia untuk
mekanisme SN1 kurang jelas
batasnya daripada fakta sterekimia mekanisme SN2. Jika ada karbokation maka karbokation tersebut
adalah planar, dan nukleofil seharusnya mempunyai peluang yang sama untuk
menyerang dari masing-masing sisi, hasilnya adalah raesemik sempurna. Meskpiun
banyak substitusi order satu menghasilkan rasemisasi sempurna, namun banyak
juga yang tidak begitu. Secara keseluruhan adalah sekitar 5 sampai 20% inversi,
meskipun dalam beberapa kasus, sejumlah kecil penahanan konfigurasi telah
ditemukan. Fakta-fakta ini mengarahkan kepada kesimpulan bahwa di dalam
kebanyakan reaksi SN1,
beberapa produk terbentuk bukan dari karbokation bebas melainkan dari
pasangan-pasangan ion. Menurut konsep ini, reaksi SN1 berlangsung
dalam cara:
Mekanisme campuran SN1
dan SN2
Beberapa reaksi substrat di bawa suatu kondisi yang
diberikan memperlihatkan seluruhnya adalah karakteristik mekanisme reaksi SN2 dan rekasi yang lain
berjalan melalui mekanisme SN1,
tetapi ada beberapa hal yang ditemukan di mana reaksi tidak dapat
dikarakterisasi dengan mudah. Reaksi-reaksi tampak ada dalam daerah perbatasan
antara SN1 dan SN2. Untuk fenomena seperti
itu, ada dua teori yang digunakan untuk menjelaskannya. Satu teori yang
mempercayai bahwa prilakuantara tersebut disebabkan oleh bukan mekanisme SN1 murni ataupun SN2 murni. Teori yang kedua
menjelaskan bahwa terjadinya fenomena tersebut karena mekanisme SN1 dan SN2 bekerja secara bersamaan, sebagian molekul bereaksi
melalui mekanisme SN1 dan
sebagian lagi bereaksi melalui mekanisme SN2.
Menurut teori mekanisme-antara,
mekanisme SN1 dan SN2 semuanya dapat ditampung
dengan satu mekanisme dasar (mekanisme pasangan-ion). Mula-mula substrat menion
menjadi pasangan ion-antara yang kemudian berubah menjadi produk.
Jika tahap penentu kecepatan reaksi adalah langkah
pembentukan pasangan ion (k1)
maka mekanisme adalah SN1, sedangkan jika tahap penentu kecepatan
reaksi adalah tahap konversi pasangan-ion menjadi produk maka mekanisme adalah
SN2.
Salah satu contoh reaksi di mana SN1
dan SN2 terjadi secara bersamaan adalah prilaku 4-metilbenzil
klorida di dalam pelarut aseton 70% (mengandung air).
Di dalam pelarut ini, hidrolisis (konversi menjadi
4-metilbenzil alkohol) terjadi melalui mekanisme SN1. Ketika ion
azida ditambahkan, alkohol masih tetap dihasilkan namun 4-metilbenzil azida
juga dihasilkan. Penambahan ion azida menigkatkan kecepatan ionisasi (efek
garam) namun menurunkan kecepatan hidrolisis. Jika lebih banyak karkation yang
terbentuk namun hanya sedikit yang berubah menjadi alkohol maka beberapa prodik
azida terbentuk melalui reaksi dengan karbokation (SN1). Akan
tetapi, kecepatan ionisasi selalu lebih lambat daripada kecepatan reaksi
keseluruhan maka sebagian azida juga terbentuk melalui reaksi SN2.
Jadi kesimpulannya adalah mekanisme SN1 dan SN2 bekerja
secara bersamaan.
Beberapa fakta reaksi substitusi
nukleofilik lain yang tampaknya melibatkan pula mekanisme-antara namun
sebenarnya adalah mekanisme SN1 dan SN2 bekerja secara
bersamaan. Sebagai contoh adalah reaksi 2-oktil brosilat aktif optis dalam
dioksan 75% (berair) menghasilkan 2-oktanol murni aktif optis 77% terinversi.
Ketika ditambahkan natrium azida maka diperoleh 2-oktil azida bersama
2-oktanol, tapi 2-oktanolnya100% terinversi. Hasil ini memperlihatkan bahwa
2-oktanol diperoleh melalui dua proses, yaitu reaksi SN2 yang
mengarah pada produk terinversi, dan proses yang melibatkan karbokation-antara
mengarah pada rasemisasi atau retensi. Ketika ditambahkan ion azida maka
ion-ion azida tersebut mencari karbokation-antara sehingga keseluruhan proses
kedua berjalan menghasilkan azida, sedangkan reaksi SN2 yang tidak
terpengaruh oleh penambahan ion azida masih tetap berjalan menghasilkan
2-oktanol terinversi.
Solvolisis 2-oktil brosilat dalam
metanol murni dan solvolisis 2-oktil metanasulfonat dalam air murni tanpa ion
azida masing-masing menghasilkan metil 2-oktil eter dan 2-oktanol dengan 100%
konfigurasi inversi. Hal ini menunjukkan bahwa mekanisme reaksi dalam pelarut
ini adalah murni SN2. Oleh karena metanol dan air adalah pelarut
yang lebih polar daripada dioksan 75% (berair), dan oleh karena peningkatan kepolaran
pelarut akan meningkatkan kecepatan SN1, maka tentunya sangat tidak
disukai proses SN1 dapat terjadi di dalam pelarut dioksan 75%
(berair). Berdasarkan fakta tersebut maka diusulkan bahwa spesies-antara dalam
proses kedua bukanlah suatu karbokation melainkan adalah ion oksomium yang
terbentuk melalui serangan SN2 oleh dioksan. Ion ini bukanlah suatu
produk yang stabil tapi bereaksi dengan air melalui mekanisme SN2
lain menghasilkan 2-oktanol dengan konfigurasi yang dipertahankan. Proses
keseluruhan dapat diperlihatkan sebagai berikut:
Beradasarkan reaksi di atas maka jelaslah bahwa bagian hasl
reaksi yang mempertahankan konfigurasi bukan terjadi dari prilaku-antara SN2
dan SN1 tapi melalui dua reaksi SN2 yang terjadi secara
berurutan.
Mekanisme SNi
Di dalam sebagian kecil reaksi,
substitusi nukleofilik berlangsung dengan mempertahankan konfigurasi, bahkan
tidak memungkinkan adanya efek gugustetangga. Di dalam mekanisme SNi (substitusi nukleofilik
internal), bagian guguspergi harus mampu menyerang substrat dari arah di mana
tersebut pergi. Reaksi antara tionil klorida dengan alkohol menghasilkan alkil
klorida adalah contoh dari reaksi jenis ini. Tahap pertama reaksi ini adalah
pembentukan klorosulfit yang kemudian mengalami transformasi menjadi alkil
klorida melalui tahap ionisasi yang sangat mirip dengan tahap pertama SN1, tapi tahap selanjutnya
adalah serangan bagian gugus-pergi dari arah depan. Hasilnya adalah pertahanan
konfigurasi.
Mekanisme tahap 3 diperkirakan adalah suatu proses
intramolekul yang melibatkan keadaan transisi siklik 34.
Di dalam mekanisme ini, pembentukan ikatan C-Cl harus
disinkronkan dengan pemutusan ikatan C-O. Serangan Cl- terjadi dari
depan sehingga memberikan kenampakan stereokimia yang sama dengan dalam ion
klorosulfit (proses stereospesifik).
Daftar Pustaka
Allinger, N. L.,
Cava, M. P., Jongh, D. C. D., Johnson, C. R., Lebel, N. A., dan Steven, C. L.,
1976, Organic Chemistry, 2nd Edition, Worth Publishers, Inc., New
York.
Bansal, R. K, 1980,
Organic Reaction Mechanisms, McRaw-Hill Publishing Company Limited, New Delhi.
Pertanyaan
1.
Buat catatan singkat yang
merupakan ciri tentang reaksi-reaksi SN1,
SN2, dan SNi.
2.
Beri alasan bahwa penggantian Br
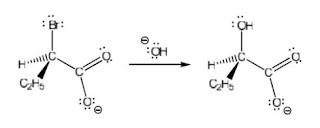
oleh OH dalam reaksi berikut bukanlah melalui mekanisme SN2 maupun SN1.
Apa sebabnya dan bagaimana mekanisme terjadinya.
3. dari tahap - tahap berikut, mengapa serangan z lebih cepat daripada serangan y






















Thanks. Menjawab nomor 2
BalasHapusReaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
BalasHapus1 .Ciri reaksi SN1:
Berlangsung melalui dua tahap reaksi
Melibatkan karbokation sebagai spesies-antara
Mengikuti hukum kecepatan reaksi orde satu (kecepatan reaksi hanya tergantung pada konsentrasi substrat)
Bila substrat kiral maka produknya adalah rasemik
Cenderung terjadi pada substrat alkil halida tersier
Lebih menyukai pelarut polar
Ciri reaksi SN2:
Berlangsung secara simultan (satu tahap reaksi) dengan hanya melibatkan keadaan transisi
Mengikuti hukum kecepatan reaksi orde dua (kecepatan reaksi tergantung pada konsentrasi substrat dan pereaksi)
Bila substrat kiral maka terjadi inversi
Cenderung terjadi pada substrat alkil halida primer
Lebih menyukai pelarut non-polar
Ciri reaksi SNi:
Berlangsung melalui tiga tahap reaksi
Melibatkan pembentukan karbokation
Melibatkan keadaan transisi siklik
Bila substrat kiral maka terjadi retensi
2. Reaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
3. gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
1 .Ciri reaksi SN1:
BalasHapus Berlangsung melalui dua tahap reaksi
Melibatkan karbokation sebagai spesies-antara
Mengikuti hukum kecepatan reaksi orde satu (kecepatan reaksi hanya tergantung pada konsentrasi substrat)
Bila substrat kiral maka produknya adalah rasemik
Cenderung terjadi pada substrat alkil halida tersier
Lebih menyukai pelarut polar
Ciri reaksi SN2:
Berlangsung secara simultan (satu tahap reaksi) dengan hanya melibatkan keadaan transisi
Mengikuti hukum kecepatan reaksi orde dua (kecepatan reaksi tergantung pada konsentrasi substrat dan pereaksi)
Bila substrat kiral maka terjadi inversi
Cenderung terjadi pada substrat alkil halida primer
Lebih menyukai pelarut non-polar
Ciri reaksi SNi:
Berlangsung melalui tiga tahap reaksi
Melibatkan pembentukan karbokation
Melibatkan keadaan transisi siklik
Bila substrat kiral maka terjadi retensi
2. Reaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
3. gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
Terima kasih, saya akan menjawab nomor 3, gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
BalasHapussangat bermanfaat artikel anda, saya akan mencoba menjawab pada pertanyaan no.3 , pada gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
BalasHapus1 .Ciri reaksi SN1:
BalasHapus Berlangsung melalui dua tahap reaksi
Melibatkan karbokation sebagai spesies-antara
Mengikuti hukum kecepatan reaksi orde satu (kecepatan reaksi hanya tergantung pada konsentrasi substrat)
Bila substrat kiral maka produknya adalah rasemik
Cenderung terjadi pada substrat alkil halida tersier
Lebih menyukai pelarut polar
Ciri reaksi SN2:
Berlangsung secara simultan (satu tahap reaksi) dengan hanya melibatkan keadaan transisi
Mengikuti hukum kecepatan reaksi orde dua (kecepatan reaksi tergantung pada konsentrasi substrat dan pereaksi)
Bila substrat kiral maka terjadi inversi
Cenderung terjadi pada substrat alkil halida primer
Lebih menyukai pelarut non-polar
Ciri reaksi SNi:
Berlangsung melalui tiga tahap reaksi
Melibatkan pembentukan karbokation
Melibatkan keadaan transisi siklik
Bila substrat kiral maka terjadi retensi
2. Reaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
3. gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
Terima kasih, saya akan menjawab nomor 3, gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
BalasHapusMakasoh aldi materi yg cukup baik gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
BalasHapusMakasih ardi :)
BalasHapusMenjawab nomor 2
Reaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
Ok coba saya
BalasHapusMenjawab nomor 2
Reaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
3. gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
BalasHapusReaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
BalasHapus1 .Ciri reaksi SN1:
BalasHapus Berlangsung melalui dua tahap reaksi
Melibatkan karbokation sebagai spesies-antara
Mengikuti hukum kecepatan reaksi orde satu (kecepatan reaksi hanya tergantung pada konsentrasi substrat)
Bila substrat kiral maka produknya adalah rasemik
Cenderung terjadi pada substrat alkil halida tersier
Lebih menyukai pelarut polar
Ciri reaksi SN2:
Berlangsung secara simultan (satu tahap reaksi) dengan hanya melibatkan keadaan transisi
Mengikuti hukum kecepatan reaksi orde dua (kecepatan reaksi tergantung pada konsentrasi substrat dan pereaksi)
Bila substrat kiral maka terjadi inversi
Cenderung terjadi pada substrat alkil halida primer
Lebih menyukai pelarut non-polar
Ciri reaksi SNi:
Berlangsung melalui tiga tahap reaksi
Melibatkan pembentukan karbokation
Melibatkan keadaan transisi siklik
Bila substrat kiral maka terjadi retensi
2. Reaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
3. gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
1 .Ciri reaksi SN1:
BalasHapus Berlangsung melalui dua tahap reaksi
Melibatkan karbokation sebagai spesies-antara
Mengikuti hukum kecepatan reaksi orde satu (kecepatan reaksi hanya tergantung pada konsentrasi substrat)
Bila substrat kiral maka produknya adalah rasemik
Cenderung terjadi pada substrat alkil halida tersier
Lebih menyukai pelarut polar
Ciri reaksi SN2:
Berlangsung secara simultan (satu tahap reaksi) dengan hanya melibatkan keadaan transisi
Mengikuti hukum kecepatan reaksi orde dua (kecepatan reaksi tergantung pada konsentrasi substrat dan pereaksi)
Bila substrat kiral maka terjadi inversi
Cenderung terjadi pada substrat alkil halida primer
Lebih menyukai pelarut non-polar
Ciri reaksi SNi:
Berlangsung melalui tiga tahap reaksi
Melibatkan pembentukan karbokation
Melibatkan keadaan transisi siklik
Bila substrat kiral maka terjadi retensi
Hai aldi, saya coba mnjwab
BalasHapus1 .Ciri reaksi SN1:
Berlangsung melalui dua tahap reaksi
Melibatkan karbokation sebagai spesies-antara
Mengikuti hukum kecepatan reaksi orde satu (kecepatan reaksi hanya tergantung pada konsentrasi substrat)
Bila substrat kiral maka produknya adalah rasemik
Cenderung terjadi pada substrat alkil halida tersier
Lebih menyukai pelarut polar
Ciri reaksi SN2:
Berlangsung secara simultan (satu tahap reaksi) dengan hanya melibatkan keadaan transisi
Mengikuti hukum kecepatan reaksi orde dua (kecepatan reaksi tergantung pada konsentrasi substrat dan pereaksi)
Bila substrat kiral maka terjadi inversi
Cenderung terjadi pada substrat alkil halida primer
Lebih menyukai pelarut non-polar
Ciri reaksi SNi:
Berlangsung melalui tiga tahap reaksi
Melibatkan pembentukan karbokation
Melibatkan keadaan transisi siklik
Bila substrat kiral maka terjadi retensi
2. Reaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
3. gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
Terimakasih materinya bung Ahmad
BalasHapusJawaban untuk soal 1 ciri SN1 yaitu
Berlangsung melalui dua tahap reaksi
Melibatkan karbokation sebagai spesies-antara
Mengikuti hukum kecepatan reaksi orde satu (kecepatan reaksi hanya tergantung pada konsentrasi substrat)
Bila substrat kiral maka produknya adalah rasemik
Cenderung terjadi pada substrat alkil halida tersier
Lebih menyukai pelarut polar
Ciri reaksi SN2:
Berlangsung secara simultan (satu tahap reaksi) dengan hanya melibatkan keadaan transisi
Mengikuti hukum kecepatan reaksi orde dua (kecepatan reaksi tergantung pada konsentrasi substrat dan pereaksi)
Bila substrat kiral maka terjadi inversi
Cenderung terjadi pada substrat alkil halida primer
Lebih menyukai pelarut non-polar
Ciri reaksi SNi:
Berlangsung melalui tiga tahap reaksi
Melibatkan pembentukan karbokation
Melibatkan keadaan transisi siklik
Bila substrat kiral maka terjadi retensi
Makasih ardi,saya akan menjawab pertanyaan nomor tiga .
BalasHapus3. gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat.
Jawaban untuk soal 1 ciri SN1 yaitu
BalasHapus Berlangsung melalui dua tahap reaksi
Melibatkan karbokation sebagai spesies-antara
Mengikuti hukum kecepatan reaksi orde satu (kecepatan reaksi hanya tergantung pada konsentrasi substrat)
Bila substrat kiral maka produknya adalah rasemik
Cenderung terjadi pada substrat alkil halida tersier
Lebih menyukai pelarut polar
Ciri reaksi SN2:
Berlangsung secara simultan (satu tahap reaksi) dengan hanya melibatkan keadaan transisi
Mengikuti hukum kecepatan reaksi orde dua (kecepatan reaksi tergantung pada konsentrasi substrat dan pereaksi)
Bila substrat kiral maka terjadi inversi
Cenderung terjadi pada substrat alkil halida primer
Lebih menyukai pelarut non-polar
Ciri reaksi SNi:
Berlangsung melalui tiga tahap reaksi
Melibatkan pembentukan karbokation
Melibatkan keadaan transisi siklik
Bila substrat kiral maka terjadi
Terima kasih ardi, saya akan menjawab nomor 3, gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
BalasHapus2. Reaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
BalasHapusHalo Aldi, terimakasih penjelasannya. Saya coba jawab pertanyaan no 2: Reaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
BalasHapusNoob noob-_-
BalasHapus2. Menurut saya reaksi ini melibatkan karbokation sebagai ciri reaksi SN1.
Terima kasih, saya akan menjawab nomor 3, gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
BalasHapusterimakasih atas materinya saya coba jawab no 2: Reaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
BalasHapusTerimakasih materinya bung Ahmad
BalasHapusJawaban untuk soal 1 ciri SN1 yaitu
Berlangsung melalui dua tahap reaksi
Melibatkan karbokation sebagai spesies-antara
Mengikuti hukum kecepatan reaksi orde satu (kecepatan reaksi hanya tergantung pada konsentrasi substrat)
Bila substrat kiral maka produknya adalah rasemik
Cenderung terjadi pada substrat alkil halida tersier
Lebih menyukai pelarut polar
Ciri reaksi SN2:
Berlangsung secara simultan (satu tahap reaksi) dengan hanya melibatkan keadaan transisi
Mengikuti hukum kecepatan reaksi orde dua (kecepatan reaksi tergantung pada konsentrasi substrat dan pereaksi)
Bila substrat kiral maka terjadi inversi
Cenderung terjadi pada substrat alkil halida primer
Lebih menyukai pelarut non-polar
Ciri reaksi SNi:
Berlangsung melalui tiga tahap reaksi
Melibatkan pembentukan karbokation
Melibatkan keadaan transisi siklik
Bila substrat kiral maka terjadi retensi
sangat bermanfaat artikel anda, saya akan mencoba menjawab pada pertanyaan no.3 , pada gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
BalasHapusno. 2. menurut saya rx ini melibatkan karbokation sbg ciri SN 1
BalasHapusThanks. Menjawab nomor 2
BalasHapusReaksi bukan SN1 maupun SN2 karena meskipun melibatkan karbokation sebagai ciri reaksi SN1, namun produknya adalah produk retensi.
Terima kasih, saya akan menjawab nomor 3, gugus Z lebih tersedia pada posisi yang tepat; sedangkan untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z melibatkan pelepasan ΔSǂ yang jauh lebih kecil
BalasHapus